编者按:为加强全球乳腺癌研究者之间的学术交流,2020年7月15日,“遇见PI”第二弹重磅来袭,KATHERINE研究全球Leading PI、美国休斯顿卫理公会医院的Charles Geyer教授连线复旦大学附属肿瘤医院胡夕春教授、河北医科大学第四医院刘运江教授等多位国内乳腺癌领域知名专家教授,针对KATHRINE研究进行深入解读和探讨,并就相关的临床病例进行深入的MDT讨论交流。
KATHERINE研究概述——Charles Geyer教授
研究背景:HER2阳性早期乳腺癌新辅助化疗联合抗HER2靶向治疗后有残存浸润性病灶的患者,其疾病复发和死亡风险更高。KATHERINE研究旨在评价以T-DM1替代曲妥珠单抗作为新辅助治疗后有残存病灶患者的辅助治疗方案。
研究设计:研究入组患者为cT1-4/N0-3/M0、经新辅助治疗后仍然有残留病灶的HER2阳性乳腺癌患者,新辅助化疗要求至少6个周期(不少于9w的紫杉醇,允许使用蒽环和烷化剂,化疗均在术前完成),新辅助靶向治疗要求至少曲妥珠单抗9w(允许双靶)。患者术后12w随机分配至T-DM1组(3.6 mg/kg IV Q3W,共14周期)和曲妥珠单抗组(6 mg/kg IV Q3W,共14周期),主要终点为iDFS(预设的最终目标为3年iDFS率从曲妥珠单抗组的70.0%提高至T-DM1组的76.5%,HR 0.75)。研究于2013年4月3日至2015年12月31日共入组了1486例患者(曲妥珠单抗组和T-DM1各743例)。
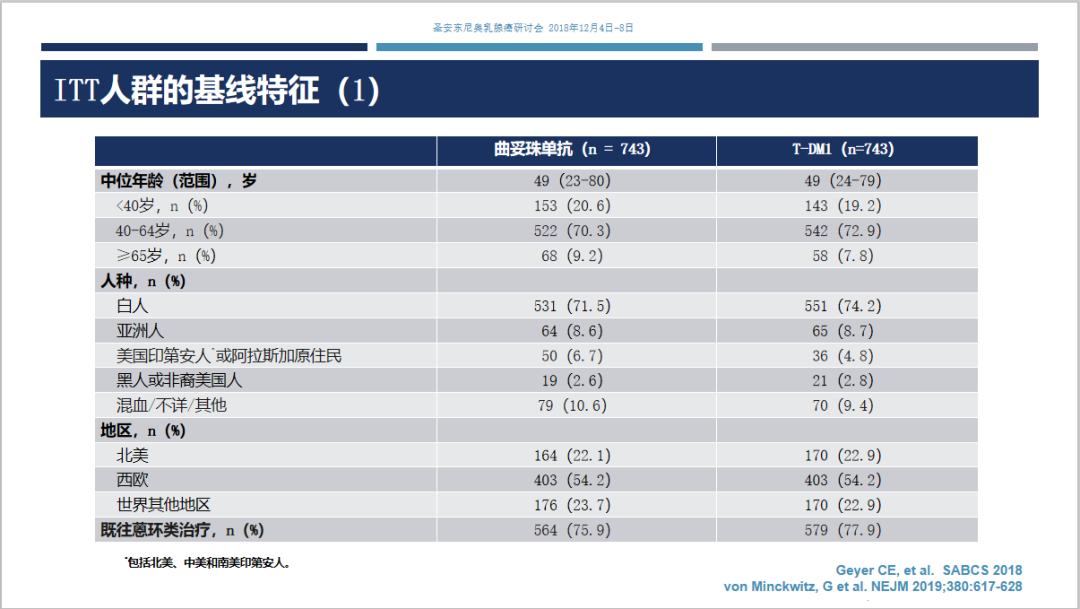
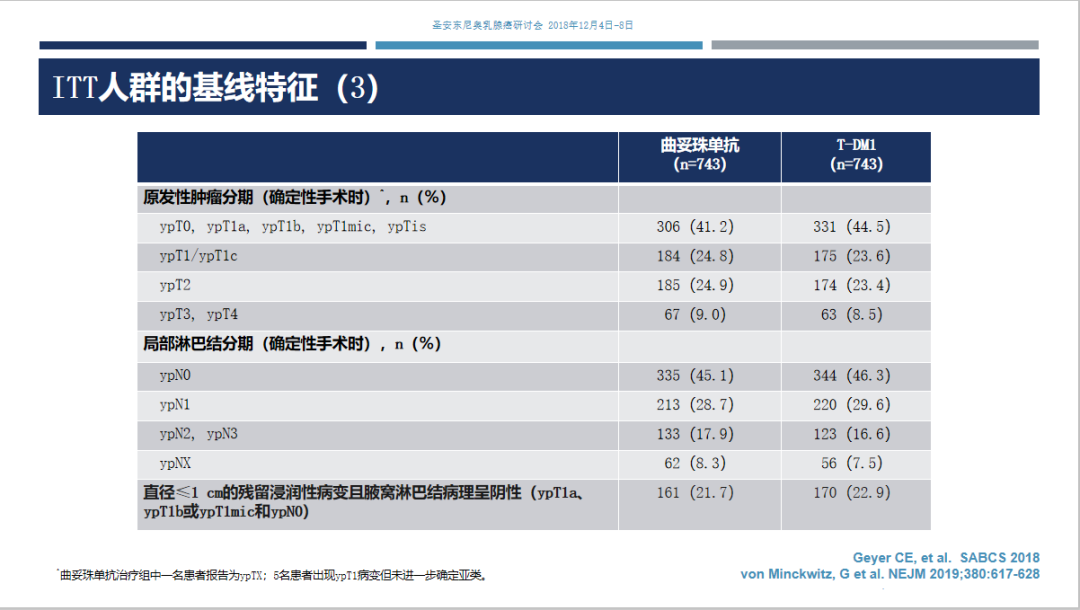
入组基线情况及ITT人群分层情况见下表。

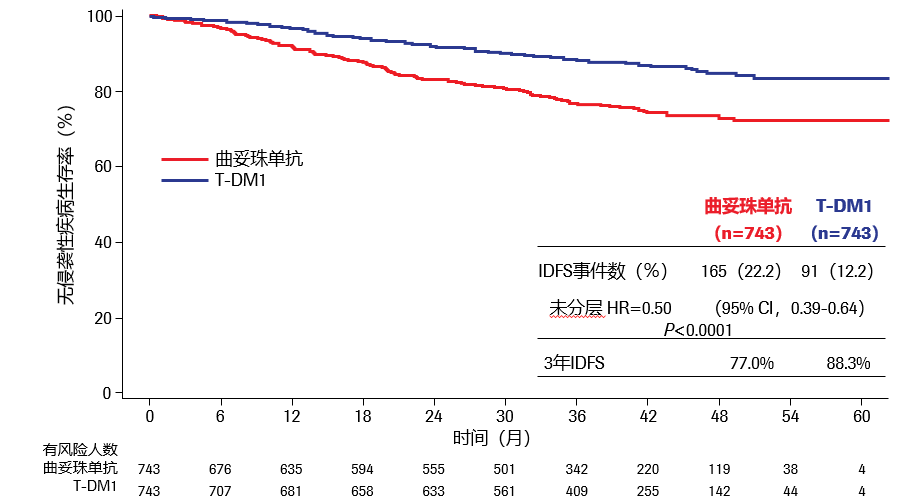
研究结果:2018年SABCS大会上报道了中位随访41个月的初次分析显示,相较于曲妥珠单抗组,T-DM1组患者的3年DFS率显著提高了11.3%(77.0% vs 88.3%,HR0.50,95% CI 0.39~0.64),乳腺癌侵袭性复发风险或死亡的降低了50%。
亚组分析可见,无论患者何种分期、HR表达状态、术前双靶或单靶、术后腋结状态均可从T-DM1辅助治疗中获益。对于新辅助治疗后腋结阴性、残存病灶≤1cm等肿瘤负荷较低的患者(ypT1a,ypT1b或ypT1mic 和ypN0),也能够从T-DM1治疗中获益(HR 0.60,95%CI 0.33~1.12);此外,KATHERINE研究中有77例临床分期为T1cN0(T-DM1组45例),其中曲妥珠单抗组有6例患者发生iDFS事件,3年iDFS率为81%(26/32),而T-DM1组尚未发生iDFS事件。
对于RCB评分较好或残余病灶较小的患者,我们看到在KATHERINE研究中仍然有获益,我们仍然推荐这部分患者使用T-DM1治疗。
在今年的ESMO-Breast cancer会议上,我们报道了这样一个结果,对KATHERINE研究中新辅助治疗后non-pCR患者的手术标本重新进行免疫组化检查发现,在70例残留病灶HER2检测阴性的患者中,42例随机分配接受曲妥珠单抗治疗的患者发生了11例IDFS事件(IDFS~74%),28例随机分配接受T-DM1治疗的患者发生了0例IDFS事件,这再次证明了这些患者是可以从T-DM1的研究中获益的,与我们之前的试验结果是一致的,这对于临床是很有意义的结果。
生物标志物表达水平与抗HER2靶向治疗结局的关系:
我们又对新辅助治疗前和/或手术标本进行了进一步的基因表达分析,并在ASCO大会上公布了结果,研究发现,PIK3CA突变状态并不影响曲妥珠单抗或T-DM1的治疗结局,T-DM1在HER2低表达组和高表达组的获益一致,此外,PD-L1、CD8、Teff等所有参与评估的生物标志物水平均不影响T-DM1的治疗获益。
在安全性方面,总体上来说,大部分患者还是耐受的。对于因AE而停止治疗的患者,我们对于停药标准的把控是非常严格的,对于实验室指标异常的患者我们进行了停药,导致没能完成最终的治疗,但这部分患者并未出现真正的临床症状;对于血小板降低的患者,我们也是能够进行很好的管理的,所以这个药物的耐受性总体上是良好的,对于考虑使用T-DM1的患者,不应该受到这样一些AE的顾虑和影响。
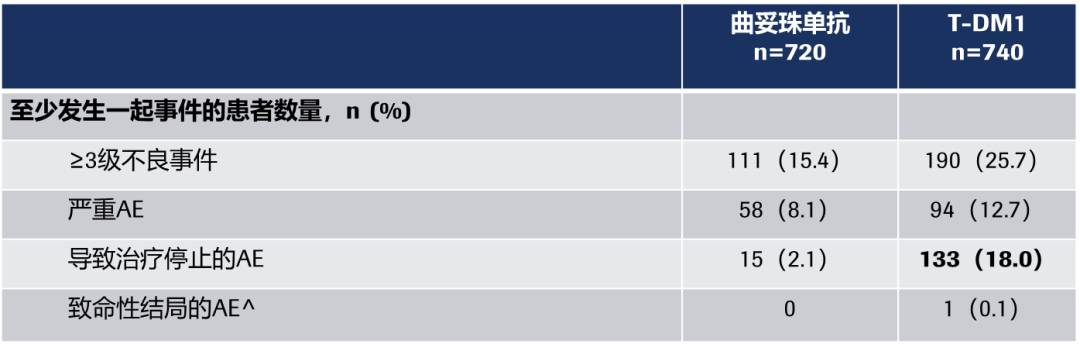
可以看到T-DM1的使用不受放疗影响,也没有证据证明两者联合会增加肺部毒性。
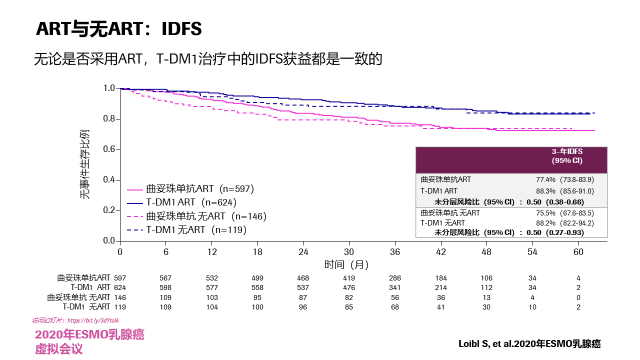
在接受和未接受内分泌治疗中,两组的HR是无差异的。
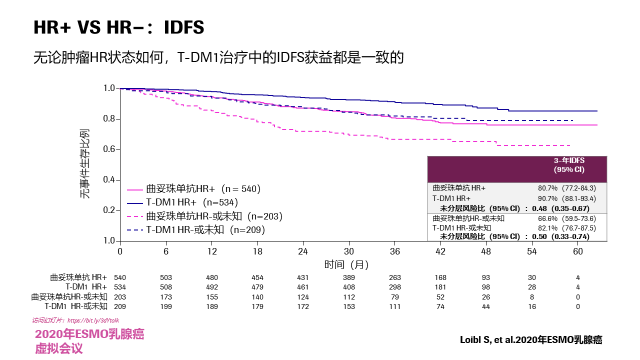
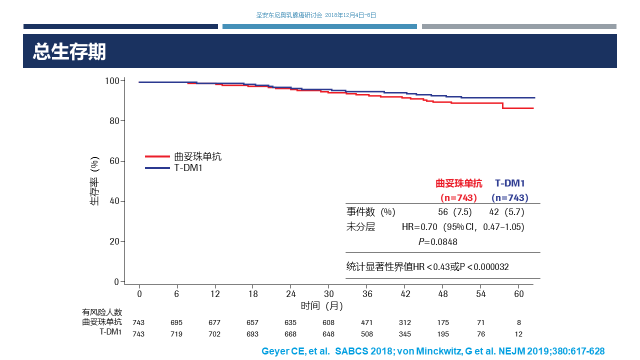
总生存:最后来看一下目前总生存的分析,曲妥珠单抗vsT-DM1组的事件数是56 vs 42,未分层风险比是0.7,当然我们还需要进一步随访,等待OS的成熟。
指南推荐情况:KATHERINE研究结果无疑对HER2+早期乳腺癌标准治疗管理产生了很大的影响,T-DM1给患者带来了获益也改变了临床实践,同时也受到了全球多个指南推荐。

李云涛教授:针对新辅助治疗后再次检测HER2表达状态,可能会对治疗选择有影响,对于HER2的低表达和高表达是根据免疫组化还是FISH的结果来判断呢?
Charles Geyer教授:我们用的是FISH或miRNA的方式来检测的,在这里面又分为高表达、低表达。其实从预后的角度来看,高表达和低表达组,使用T-DM1后差异不大。对于新辅助治疗使用了曲妥珠单抗+帕妥珠单抗的治疗,可能有人认为会有更好的疗效,但如果有残留病灶的话,后续还是应该用T-DM1来治疗。
水若鸿教授:对于这个问题我的理解是这样,这部分病人应该都是基于HER2阳性患者再进行miRNA水平的细分。HER2阳性的乳腺癌患者新辅助治疗后能不能达到pCR已经成为了新的治疗决策点,所以对新辅助治疗后的病理评估的准确性显得非常重要,目前对于pCR的定义还是比较明确的,即乳腺原发病灶及腋窝淋巴结均无浸润癌残留。我的问题的是,一、原发灶没有癌,淋巴结中仅存ITC;二、原发灶和淋巴结中都没有明显的浸润性癌,在瘤床中出现了少量脉管内癌栓,这两种情况目前都是当作non-pCR来看待的,所以想请教Geyer教授,这两种情况有没有必要进行T-DM1的强化治疗?
Charles Geyer教授:这两种都是属于特别极端的情况,在现实中我们很难去做一个标准治疗方案,目前我的观点是,这些患者用曲妥珠单抗可能也是有效的,但是用T-DM1可能效果会更好,所以需要平衡预后和不良反应去判断。即使是非常小的病灶,我都是建议T-DM1治疗的,这样会给患者更多治愈的机会。所以就算是这样极端的情况下,我仍然是建议T-DM1治疗的。
汪洁教授:感谢Gayer教授给我们的讲解,给我许多启示。我想问一个问题,是关于患者新辅助治疗的疗程和剂量的选择问题,有一些患者可能在3-4个疗程时,肿块或淋巴结就已经消失了,直接就进行了手术,并且也达到了pCR,此时我们是否需要扩大手术范围?后续残留病灶如果是微浸润,是否应该继续使用T-DM1治疗?
Charles Geyer教授:目前美国也有很多新辅助降阶梯的研究正在进行,我们也考虑到了这样的问题。最近也有一个类似的患者,一个年轻女性,有盆腔寡转移,新辅助治疗后由于一些毒性反应,我们进行了手术,有了非常少的残留病灶,我们使用了T-DM1进行了后续的治疗,这也是KATHERINE研究带给我们的启示。
赵卫红教授:对于残余病灶很小的患者,似乎没有达到统计学差异,这一点Gayer教授是否能够解答一下?另外入组患者中有一小部分也采用了双靶治疗,这部分患者的情况是否能再详细解释一下?
Charles Geyer教授:1.统计学差异其实是针对整个研究的,对于亚组分析结果,我们主要考虑它和整体结果的一致性,在亚组分析中,我们很少会去看统计学意义的,所以在KATHERINE研究中很多亚组能出现统计学意义已经是很了不起的,但不代表所有亚组都会出现统计学意义。
2.在美国有一些患者是进行了双靶治疗,这也是很有代表性的亚组,他们的HR和单靶治疗是相似的,所以如果有残留病灶,他们对T-DM1的获益是一致的,但从结果来看,新辅助接受双靶治疗后又接受T-DM1 的治疗组获益是更加明显的,高出4%,所以针对这部分患者仍然应使用T-DM1治疗;对于单靶治疗后non-pCR的患者,后续也可以考虑使用双靶治疗,当然这样的治疗方案肯定比单靶是更优的,但相比T-DM1来说,我认为还是T-DM1更好一些,除非这个患者有一些不能耐受的因素,对我来说,我会尽一切的努力让患者达到无瘤状态,而且T-DM1也没有对患者的生活质量产生特别不好的影响,我认为还是需要去尝试T-DM1的治疗。
刘金钊教授:张某,女性,48 岁,未绝经,主诉:左乳肿物1月余,专科查体:左乳外侧距乳头边缘2.0cm可触及一大小约4cm×3cm肿物,质硬,边界不清,表面不规整,活动度差;左腋下可触及一直径约2cm淋巴结,质硬,活动度可。
乳腺超声:左乳腺体层囊实性占位 BI-RADS 5类,左腋下、锁下多发淋巴结肿大。
乳腺核磁共振:左乳外下象限肿物 BI-RADS 5类,左侧腋窝多发肿大淋巴结。
穿刺病理:左乳肿物:乳腺浸润性导管癌Ⅱ级,左腋下淋巴结:癌转移,左锁骨下淋巴结:癌转移。
免疫组化:ER(10%),PR(10%), HER-2(3+), Ki-67(30%)
诊断:左乳癌 cT2N3M0 IIIC期
治疗经过:化疗时间:2019.02.27-2019.06.15,治疗方案:TCbH 1/21d×6。6周期化疗后 2019.06.15,专科查体:左乳外侧距乳头边缘2.0cm可触及一大小约2.5cm×2.5cm肿物,质硬,边界不清,表面不规整,活动度差;双侧腋下及锁骨上下未触及肿大淋巴结。
术前诊断:左乳癌 cyT2N0M0 IIA期
手术日期:2019.07.08
手术方式:左乳癌改良根治术
术后病理:左乳肿物:2cm×1.5cm×1cm,乳腺浸润性导管癌合并导管原位癌,MP 分级:4级。淋巴结:腋窝0/4,第一水平0/8,第二水平0/2转移,肌间组织为软组织。
免疫组化:ER(60%) PR(70%) HER2(浸润区2+,待FISH检测,导管原位癌区3+) Ki67(30%),FISH:阴性
Charles Geyer教授:这是一个很有意思的病例,她是一个HER2表达水平较低的患者,我们看到前期她有一个较好的应答,腋窝也没有残留病灶了,这个患者我建议使用T-DM1联合放疗联合内分泌的治疗,会有一个非常好的结果。
张少华教授:这是一个non-pCR、MP4级的患者,根据 KATHERINE研究,后续的治疗T-DM1肯定是一个首选,当然其他教授也提到了,这个患者之前是单靶治疗,那么后续是选择双靶还是T-DM1目前还没有定论,根据循证医学T-DM1应该是首选,如果考虑到耐受性和经济的问题,双靶也是一个可以选择的方案,这个病人腋结和锁骨下淋巴结阳性,所以还是要联合放疗的,但是不知道术中锁骨下淋巴结是否清扫,可能对局部放疗的剂量有一些区别。
过兆基教授:这个病例是一个治疗和评估都非常规范的病例,结合KATHERINE临床试验,有70例类似的患者,手术后HER2转阴了,42例随机分配接受曲妥珠单抗治疗的患者发生了11例IDFS事件(IDFS 74%),28例随机分配接受T-DM1治疗的患者发生了0例IDFS事件,所以这个患者如果不考虑经济因素,T-DM1依然是一个治疗的金标准,我非常支持使用T-DM1。
黄亮教授:在KATHERINE研究之前,如果HER2阳性变成阴性,我们是不知道该如何治疗的,现在有了KATHERINE研究给我们带来了临床证据,使用T-DM1能给这类人群带来了获益,所以我建议辅助治疗使用T-DM1。
刘引教授:对于这个病例我没有什么问题,但我有几个问题想问Gayer教授,1.双靶新辅助治疗已经越来越常见了,对于患者来说,新辅助治疗阶段就接受了双靶治疗,术后未达pCR的患者,是T-DM1单药治疗还是需要T-DM1联合帕妥珠单抗?2.我们从KATHERINE研究中看出,很多患者新辅助接受了蒽环类药物治疗,我们还是会关注是否会带来心脏毒性的问题,您是支持多西他赛联合靶向治疗序贯蒽环方案,还是TcbHP方案?3.关于T-DM1毒性,血小板减少是一个相对常见的并发症,特别是亚洲人群好像比欧美更容易出现一些不可逆的血小板减少,所以在临床使用过程中,我们对它的毒性还是比较关注的,能否给我分享一下发生不可逆的血小板减少时,您是如何处理的?
Charles Geyer教授:1.我们也研究了T-DM1单药对比联合抗体药物的治疗,好像并没有太大的获益,如果说患者在新辅助治疗时已经用了双靶,仍然有残余病灶,我们会考虑做一些进一步的研究,但目前的标准治疗依然是T-DM1。2.我之前可能还是会考虑蒽环序贯方案,但我也看到荷兰的TRAIN-2研究结果,PH双靶联合蒽环或无蒽环新辅助方案疗效相当,因此我也会受此研究的影响,考虑不含蒽环的方案。3.对于持续性不可逆的血小板减少,我还没有遇到过,所以我也没有太多的经验,不过我和中国的研究者有过相关的探讨,好像亚洲女性的血小板减少是一个问题,这就要回归到我们对于个体的评估。但我们不可否认KATHERINE研究对我们还是有帮助的,我们要认识iDFS对我们的意义,从减少绝对风险的角度出发,如果真的出现了血小板持续性减少,那可能是一件很不幸的情况。但我了解好像没有出现中性粒细胞的降低和贫血,不知道是不是第一个剂量后血小板就降低了,还是有一个进行性下降,是否会有过恢复?对我来说这些还是需要关注的,但如果是毫无预兆的下降,确实是个比较难以管理的问题。
刘月平教授:我是一个病理科医生,我想解释一下这个患者出现了术前和术后病理不一致的情况,主要有以下几种可能性,1.由于肿瘤的异质性,穿刺活检的局限性,可能在同一个肿瘤中本身就存在HER2阳性和阴性两种不同的细胞簇,治疗后把HER2阳性表达的癌细胞杀死了,剩下了HER2阴性表达的部分,所以术后病理表现为由阳转阴的情况,2.可能确实存在一些HER2由阳转阴的情况,治疗后HER2表达确实发生了改变。
吕雅蕾教授:我想请教一下Gayer教授一个问题,伴随HER2转阴,HR状态也发生了改变,后续的内分泌治疗您将会如何选择?
Charles Geyer教授:因为她是一个局部晚期的乳腺癌,术后HR状态有一些改变,我会使用卵巢OFS+AI的选择,因为这是一个比较高危的患者,患者48岁未绝经,不过内分泌治疗需要治疗5年的时间,如果不用AI,也可以考虑使用OFS+TAM,需要根据患者整体的不良反应情况,来调整内分泌治疗的方案。
胡夕春教授:非常感谢Charles Geyer教授今天为我们精彩的讲解,让我们对于T-DM1这个药物有了更好的了解,在您的讲解之后我们又进行了病例的分享,由于之前T-DM1还未在中国上市,这个患者未能用上,但是现在T-DM1已经上市了,所以我认为对于这个患者如果后续用T-DM1可能会有一个更好的疗效。感谢线上所有嘉宾的参与,感谢Charles Geyer教授的倾情分享,耐心解答我们的每一个问题,也谢谢大家提出的精彩问题,谢谢!





 京公网安备 11010502033352号
京公网安备 11010502033352号