编者按:随着基因检测水平的提升,可在较大的基因组数据中发现更多肿瘤特异性突变,为乳腺癌的治疗和预后提供指导;另一方面,基于大规模人群的癌症易感基因分析,可筛选出与乳腺癌风险相关的基因。近日,《肿瘤学年鉴》和《新英格兰杂志》分别发表了以下3项乳腺癌基因检测的相关研究。
基因“全景”分析:这些突变特征与乳腺癌治疗、预后相关
在恶性肿瘤的进化过程中,不同的内源性和外源性突变都发挥了驱动作用,比如异常的DNA编辑、诱变剂或与年龄相关的DNA改变等。这些突变特征形成了肿瘤特异性的基因组,可在较大的基因组数据中识别出来。
日前,德国乳腺研究组(GBG)、法兰克福大学Sibylle Loibl教授牵头的一项研究,评价了突变特征的基因组模式与乳腺癌的临床行为,尤其是是化疗反应和生存率,以及治疗抵抗性疾病等。该研究成果发表于近期的《肿瘤学年鉴》(Ann Oncol)。
这项研究对来自前瞻性新辅助多中心GEP研究的405例治疗前样本进行全外显子测序,分析了11个突变特征,包括APOBEC突变、同源重组缺陷(HRD)、错配修复缺陷,以及年龄相关或烟草诱导的变异。
结果显示,乳腺癌的不同亚组主要由HRD相关和APOBEC相关突变特征的差异决定,激素受体(HR)阴性和HR阳性肿瘤之间存在显著差异,并与年龄、Ki-67和免疫学参数相关。

图1. HR阳性和阴性乳腺癌突变特征的比较:(A)HR阴性和阳性肿瘤每个特征突变的绝对数;(B)免疫组化检测1例高EMR、高MMR相关信号S15、S21、S26的肿瘤微卫星不稳定性(MSI)
该研究确定了与提高新辅助化疗pCR率相关的一些突变。在HR阳性肿瘤特征的单变量分析中,S3(HRD,P<0.001)和S13(APOBEC,P=0.001)以及外显子突变率(EMR,P=0.002)与pCR率的增加显著相关。特征信号S3(HRD,P=0.006)和S4(烟草,P=0.011)是化疗耐药肿瘤患者DFS率降低的预后因素。
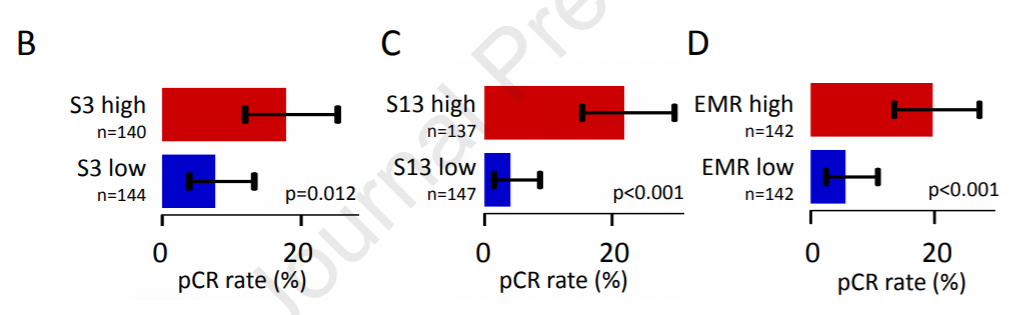
图2. 高或低S3(HRD)、S13(APOBEC)、EMR突变特征HR阳性肿瘤的pCR率
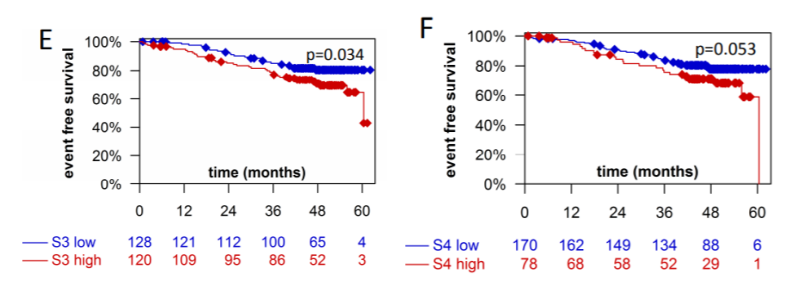
图3. 高或低S3(HRD)、S4(吸烟)突变特征HR阳性肿瘤的无事件生存率
小结:该研究强调了肿瘤的发展是由内、外源性突变过程长期驱动的,这些过程使得每个肿瘤产生了特定的突变特征。通过对405个肿瘤样本的突变特征分析发现,一些突变特征与治疗、预后相关,尤其是HRD、APOBEC和烟草相关的变异与治疗反应和生存率相关。
NEJM背靠背发文:两项大规模人群的乳腺癌易感基因研究
乳腺癌易感基因检测虽然已被广泛采用,但是大多数基因与乳腺癌的关联证据仍较薄弱,潜在风险推算不精准,且缺乏可靠的亚型相关风险推算。日前,《新英格兰医学杂志》背靠背刊载了两项乳腺癌遗传易感基因的研究。
一项来自国际乳腺癌协会联盟报告的研究,纳入来自25个国家的60466名乳腺癌女性和53461名对照者女性,分析34个基因与乳腺癌风险的关联。
结果显示,ATM、BRCA1、BRCA2、CHEK2、PALB2等5个基因的蛋白质截短变异与乳腺癌风险显著相关(P<0.0001),BARD1、RAD51C、RAD51D、TP53等4个基因的蛋白质截短变异也与乳腺癌风险相关(P<0.05,贝叶斯错误发现概率小于0.05)。其余25个基因中有19个基因的蛋白质截断变异比值比95%置信区间上限小于2.0。
对于ATM、CHEK2的蛋白质截短变异体,雌激素受体(ER)阳性疾病的优势比高于ER阴性疾病;对于BARD1、BRCA1、BRCA2、PALB2、RAD51C、RAD51D的蛋白质截短变异体,ER阴性疾病的优势比高于ER阳性疾病。
ATM、CHEK2、TP53的罕见错义变异总体上与乳腺癌风险相关(P<0.001)。对于BRCA1、BRCA2、TP53,根据标准分类为致病性的错义变体总体上也与乳腺癌总体风险相关,风险与蛋白质截短变体相似。

另一项美国癌症协会联合美国、德国、英国多中心报告的研究,对32247名乳腺癌女性和32544名正常女性进行28个已知癌症相关基因的测序。
结果显示,在12个已知的乳腺癌易感基因中,乳腺癌组和对照组分别有5.03%和1.63%的女性检测出致病性变异。其中,BRCA1和BRCA2致病性变异与乳腺癌的高风险相关,优势比分别为7.62(95%CI:5.33~11.27)和5.23(95%CI:4.09~6.77)。PALB2致病性变异与中度风险相关(OR 3.83;95%CI:2.68~5.63)。
BARD1、RAD51C、RAD51D致病性变体与ER阴性乳腺癌和三阴性乳腺癌(TNBC)的风险增加相关,而ATM、CDH1、CHEK2致病性变体与ER阳性乳腺癌的风险增加相关。
其余包括NBN基因(c.657_661del5致病变异)在内的16个候选乳腺癌易感基因与乳腺癌风险增加无关。
表1. 12种基因与ER+/-乳腺癌、TNBC的风险

小结:这两项研究在较大规模的欧美女性样本中,提供了乳腺癌风险预测的易感基因组合。这些风险评估可以为癌症检测和筛查提供信息,并改善携带此类遗传性变异体女性的临床管理策略。
[1]Denkert C, Untch M, Benz S, et al. Reconstructing tumor history in breast cancer: signatures of mutational processes and response to neoadjuvant chemotherapy [published online ahead of print, 2021 Jan 5]. Ann Oncol. 2021;S0923-7534(20)43224-7. doi:10.1016/j.annonc.2020.12.016[2]Breast Cancer Association Consortium, Dorling L, Carvalho S, et al. Breast Cancer Risk Genes - Association Analysis in More than 113,000 Women [published online ahead of print, 2021 Jan 20]. N Engl J Med. 2021;10.1056/NEJMoa1913948. doi:10.1056/NEJMoa1913948[3]Hu C, Hart SN, Gnanaolivu R, et al. A Population-Based Study of Genes Previously Implicated in Breast Cancer [published online ahead of print, 2021 Jan 20]. N Engl J Med. 2021;10.1056/NEJMoa2005936. doi:10.1056/NEJMoa2005936 




 京公网安备 11010502033352号
京公网安备 11010502033352号