编者按:在西方,滤泡性淋巴瘤是第二大最常见的非霍奇金淋巴瘤亚型,且无法治愈。大约有20%的滤泡性淋巴瘤患者在一线治疗后2年内复发。此外,随着治疗线数的增加,复发难治滤泡性淋巴瘤患者的临床结局也逐渐恶化。这同时也凸显了对于新的治疗方法的迫切需求。Tisagenlecleucel是一种CD19嵌合抗原受体T细胞(CAR-T)免疫疗法,Ⅱ期ELARA试验是一个单臂、多中心、非盲试验,用来评估tisagenlecleucel在治疗复发性或难治性滤泡性淋巴瘤成人患者时的安全性和有效性。一共有12个国家,32个研究中心参与这项研究。本期“热血碧涛谈”血液专栏,我们邀请北京大学肿瘤医院朱军教授点评本次ASCO大会ELARA研究(Oral Presentation;摘要号7508)的结果,畅谈此项研究结果背后带给我们哪些启示。


研究探索Tisagenlecleucel在成人复发难治滤泡性淋巴瘤的有效性及安全性分析。
没有3B期疾病组织学转化的证据,且之前没有抗CD19治疗或异基因干细胞移植的1级、2级或3A级滤泡性淋巴瘤患者可以参与该试验。所有患者可以接受桥接化疗,但在治疗前需重新评估患者的病情。
研究的设计主要分为以下步骤:1.留取病人血标本并冷冻保存;2.入组患者;3.Tisagenlecleucel制备;4.开始清淋;5.输注Tisagenlecleucel。整个过程中,必要时可桥接化疗。该研究主要终点为CRR,次要终点为ORR、DOR、PFS、OS、安全性及细胞动力学。
清淋方案:氟达拉滨(25mg/m2 d1-d3 ivgtt)+环磷酰胺(250mg/m2 d1-d3 ivgtt)或每日静脉输注苯达莫司汀(90mg/m2 d1-d2 ivgtt);Tisagenlecleucel输注剂量范围:0.6-6*108 CAR-阳性存活的T细胞。

一共入组98例患者,97患者进行了Tisagenlecleucel输注,中位随访时间为10.6个月(4.3-19.7),其中有94例可进行疗效评价,中位随访时间为10.9个月(4.3-19.7)。患者中位年龄为57岁,其中有24名患者年龄大于65岁。Tisagenlecleucel的中位输注剂量为2.06x108 CAR-阳性活T细胞。18%的患者在门诊接受静脉输注tisagenlecleucel。入组时临床分期为Ⅲ-Ⅳ期患者人数为82(84.5%),入组时FLIPI≥3分患者人数为58(59.8%)。中位治疗线数为为4线(2-13),其中27.8%的患者接受大于5线治疗,共有59.8%的患者在接受抗CD20单克隆抗体治疗后24个月内疾病进展,76.3%的患者对于两种及以上化疗方案无效。在既往治疗中,20.6%的患者接受PI3K抑制剂治疗。36.1%的患者接受过自体造血干细胞移植。桥接治疗是最常见的化学免疫治疗,占43.3%。
总体安全性评价:在可评估安全性的97例患者,发生可能与治疗药物相关的3/4级AE患者人数为44(45.4%),3例患者死于进行性疾病,AE发生时治疗方案主要为托珠单抗及糖皮质激素。细胞因子释放综合征发生率为48.5%,神经毒性不良反应发生率为9.3%,所有NE和CRS均通过适当的措施得到解决。
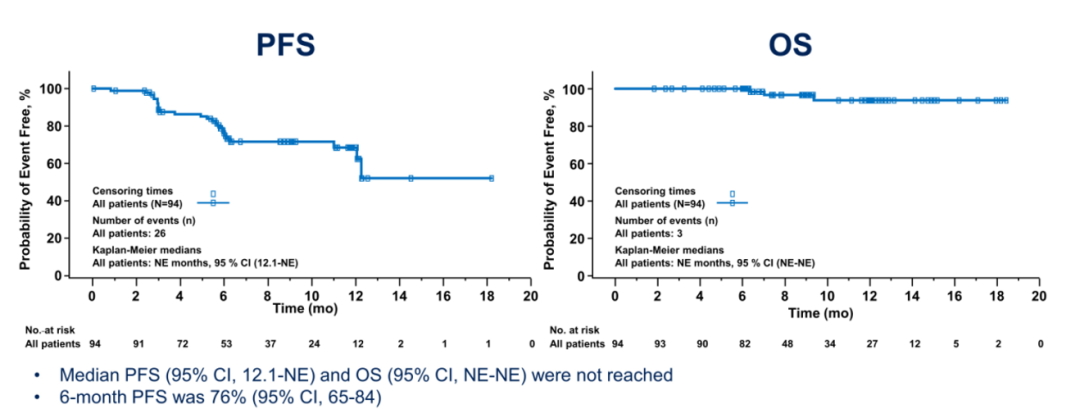
CRR为66%,ORR为86.2%,主要研究终点已经达到,中位DOR尚未达到,中位PFS及OS尚未达到。6个月PFS为76%(95%CI,65-84)。
在这项Ⅱ期临床试验中,ELARA研究表明了Tisagenlecleucel对于复发难治性滤泡淋巴瘤患者治疗的有效性(包括高风险组),且安全性数据与此前已报道的的有关Tisagenlecleucel安全情况相符。在≥2线治疗后,作为治疗难治复发性滤泡性淋巴瘤的一种疗法,Tisagenlecleucel值得进一步探索。
CAR-T是一种细胞免疫治疗方法,在体外对来自患者的T细胞进行改造,使其表达能够特异识别肿瘤细胞表面靶点的受体——嵌合抗原受体(CAR),然后再回输到患者体内发挥抗肿瘤作用。自2017年开始,美国食品与药物管理局(FDA)已经批准多款CAR-T产品上市,用于治疗复发难治B细胞非霍奇金淋巴瘤、急性淋巴细胞白血病、多发性骨髓瘤。2021年3月5日,美国FDA已经批准了首款用于治疗滤泡性淋巴瘤(FL)患者的CAR-T产品,axicabtagene ciloleucel。在其关键研究ZUMA-5(NCT03105336)中,评估了axicabtagene ciloleucel在先前接受过≥2线系统性治疗复发难治FL患者中的疗效和安全性,81例患者接受治疗,ORR达到91%,完全缓解(CR)率为60%,中位至缓解时间为1个月,中位DOR未达到。在FL患者中展现出显著和持久的临床疗效及可控的安全性。在本项ELARA研究中,Tisagenlecleuel在FL患者中也显示了积极的疗效,使其成为复发性和难治性FL患者的另外一个潜在最佳治疗选择。因此,我们有理由相信,FL患者将迎来第二款CAR-T产品。
CAR-T细胞治疗研究在中国也在如火如荼进行中,国内也迎来了首款上市产品, 根据中国国家药品监督管理局(NMPA)于2021年6月22日药品批准证明文件最新公示显示,复星凯特CAR-T细胞治疗产品益基利仑赛注射液(又称阿基仑赛,代号:FKC876,受理号CXSS2000006国)已正式获得批准。但我们应该清楚目前所面临的挑战,比如开展更多基础及临床研究,进一步提高细胞治疗疗效,降低毒副反应等。更重要的是,细胞治疗作为一种高度个体化治疗方式,存在诸多环节,我们应更多地思考如何合理规范应用这一疗法,使更多患者获益。





 京公网安备 11010502033352号
京公网安备 11010502033352号