?I-Spy 2 研究简介
一直以来,高危HER2阴性乳腺癌的新辅助治疗疗效有待提升。从机制上来说,癌细胞的DNA修复缺陷可产生具有免疫原性的新抗原,激活STING通路,PARP抑制也可上调PD-L1的表达,I-SPY 2研究正是一次PARPi与免疫疗法(IO)在这类乳腺癌新辅助治疗中的探索。本届AACR虚拟大会上,报道了I-SPY 2研究的结果,数据显示,在新辅助化疗中加入奥拉帕利(PARP抑制剂)和度伐利尤单抗(PD-L1抑制剂)可以提高II期或III期高危HER2阴性乳腺癌女性的病理完全缓解(pCR)。
I-SPY2是一项多中心、2期临床试验,研究纳入了II/III期HER2阴性的高危乳癌患者,这些患者必须有明确的靶病灶(大小≥2.5cm),ECOG评分<2分。如果激素受体是阳性,需要经MammaPrint评分评估为高复发风险患者。所有患者整体治疗计划为术前新辅助+手术+术后辅助的治疗方式。其主要终点为病理完全缓解(pCR, ypT0/is ypN0)。该试验采用了贝叶斯统计分析,通过分子标志(HER2以及激素受体状态)与对照组相比较,测量在Ⅲ期研究中试验组患者的优越性。
研究分为2组,73例HER2阴性(其中21名为HR阴性,52名为HR阳性)患者接受每4周1次的度伐利尤单抗1500mg×3,奥拉帕利100 mg每天2次,第1-11周,紫杉醇80 mg/㎡/周×12(DOP),然后阿霉素/环磷酰胺(AC)×4,对照组299名HER2阴性患者,仅接受每周紫杉醇 80mg/㎡ ×12, 然后AC×4。主要研究终点为pCR(病理性完全缓解)。所有患者在3和12周时进行MRI检查和治疗反应评估,累积的pCR数据用于研究组pCR率的预估、更新和预测。当300例患者的3期新辅助治疗研究中,按照恰当的标志物,Bayesian预测成功可能性>85%时,研究结束。
开始招募后的13个月,所有HER2-和HR+/HER2-队列均达到>0.85预测成功可能性。72例患者完成手术治疗并可评估是否pCR。对于所有HER2阴性患者,在未来3期研究中,证实DOP组pCR率高于对照组的最终预测成功概率为:HER2-组为81%(预估pCR率37%),TNBC组为80%(预估pCR率47%),HR+/HER2-组为74.5%(预估pCR率28%)。
最终结果显示,单纯紫杉醇的新辅助治疗组的pCR率为20%,度伐利优单抗+奥拉帕利+紫杉醇的pCR率为37%,提升近一倍的完全缓解率。其中,HER2阴性/ER阳性人群中,两组的pCR率分别为14%:28%,在TNBC中,两组的pCR率分别为27%:47%。
治疗过程中未见预期外毒性,10例(14%)患者可能有免疫或奥拉帕利治疗相关的2/3 级AEs(3例肺炎,2例肾上腺功能不全,1例结肠炎,1例胰腺炎,2例LFT(血清铁蛋白)升高,1例皮肤毒性,2例甲减,1例甲亢,1例食管炎)。
因此,与新辅助化疗相比,度伐利尤单抗联合奥拉帕利与紫杉醇可显著改善高风险HER2阴性II/III期乳腺癌患者pCR,其亚组HR+和TNBC均有改善。
在既往类似的研究中,同为II期临床研究的GeparOLA研究于2019年ASCO年会上公布了其结果,当时,这一研究将奥拉帕利的治疗人群扩大至包含体系BRCA突变及HRD高评分的HER2阴性乳腺癌患者,探索了紫杉醇联合奥拉帕利对比紫杉醇联合铂类用于新辅助治疗的疗效。
GeparOLA研究纳入HER2阴性早期乳腺癌患者,同时携带g/tBRCA突变和(或)HRD高评分。患者被随机分为两组,分别接受紫杉醇+奥拉帕利(PwO组,n=65)或紫杉醇+卡铂(PwCb组,n=37),再序贯表阿霉素/环磷酰胺(EC)治疗。研究主要终点为病理完全缓解率(pCR,定义为ypT0/is ypN0);次要终点为其他定义的pCR率、保乳率、临床和影像学缓解率、耐受性和安全性。
研究共随机了107例患者,其中106例患者开始研究药物治疗。患者中位年龄47岁。cT1、cT2和cT3的患者分别占36.2%、61.0%和2.9%;cN+患者占31.8%;G3患者占86.8%;Ki-67>20%患者占89.6%;TNBC占72.6%;确认g/tBRCA 1/2突变的患者占60.4%。
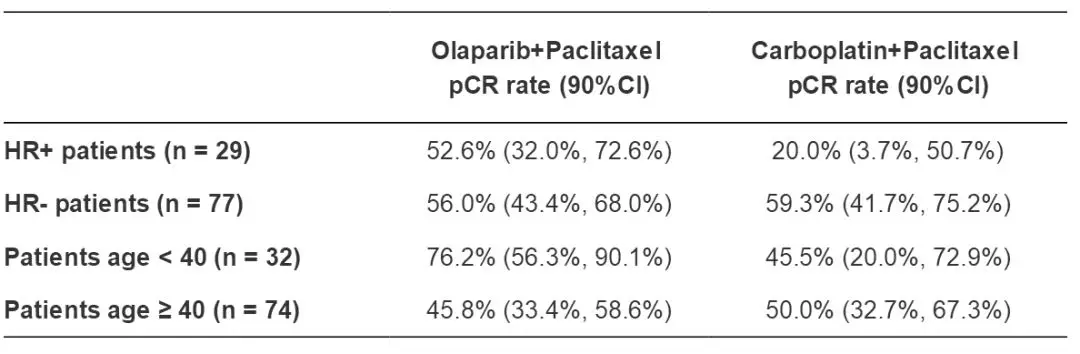
分析结果显示,PwO组和PwCb组的pCR率分别为55.1%(90%CI为44.5%~65.3%)和48.6%(90%CI 34.3%~63.2%)。
进一步的患者分层分析显示:在HR+组中,PwO组和PwCb组的pCR率分别为52.6% vs. 20%;HR-组中为56.0% vs. 59.3%; 在<40岁组中pCR率分别为76.2% vs. 45.5%,而≥40岁组中pCR率分别为45.8% vs. 50.0%。
GeparOLA研究即在早期乳腺癌新辅助治疗中进行了探索,并将人群进一步扩展至BRCA突变胚系及体系突变以及同源重组修复缺陷的HRD高评分乳腺癌患者。
1. 作为一种口服多聚ADP核糖聚合酶(PARP)抑制剂,奥拉帕利通过利用DNA损伤修复缺陷,优先杀伤存在修复缺陷的肿瘤细胞;度伐利优单抗是一个人源的PD-L1单克隆抗体,能够阻断PD-L1和CD80的结合,从而阻断肿瘤免疫逃逸并释放被抑制的免疫反应,两种药物均具有一定的抗肿瘤潜力。既往研究显示,PARP抑制剂显著增加PD-L1表达水平[1],并能激活STING/TBK1/IRF3通路,增加趋化因子如CXCL10和CCL5的表达[2],并诱导细胞毒性T淋巴细胞的活化和功能[3,4],PARP抑制剂联合免疫检查点抑制剂(ICI)治疗在复发卵巢癌和乳腺癌的维持治疗中已取得显著成效[5-7]。
2. 与GeparOLA研究相比,I-SPY 2研究在新辅助化疗中加入奥拉帕利和度伐利尤单抗,进一步扩大了研究人群至II/III期HER2阴性的高危乳癌患者,不再局限于携带g/tBRCA突变和(或)HRD高评分人群;
3. 疗效方面:GeparOLA研究中,紫杉醇+奥拉帕利组对比紫杉醇+卡铂组的pCR率分别为55.1%和48.6%,而在I-SPY 2研究中,这一提升更加明显,度伐利优单抗+奥拉帕利+紫杉醇对比紫杉醇组的pCR率为37% vs. 20%,提升近一倍的完全缓解率。
4. 在不同激素受体(HR)状态的患者中,GeparOLA研究和I-SPY 2研究均显示出在HER2-/HR+患者中pCR率的显著改善,而在I-SPY 2研究中,在HER2-/HR+及TNBC患者中,三联疗法似乎都能使患者受益。
5. 2期I-SPY 2研究响应自适应随机方法对一个共同的对照组进行了多种方案的测试,预估在3期试验中,度伐利优单抗+奥拉帕利+化疗联合使用的贝叶斯预测概率优于对照300名患者中有81%达到了“成功毕业”的门槛。
6. 在毒性方面,三联疗法未见预期外毒性,不良事件(AE)与已知的副作用一致。其中炎症反应较多(肺炎、结肠炎、食管炎、胰腺炎),可考虑血象密切监测,抗生素合理使用;有潜在甲状腺危象(甲亢、甲减),建议内分泌科跟踪监测。
Reference:
1. Jiao S, Xia W, Yamaguchi H, et al. PARP inhibitor upregulates PD-L1 expression and enhances cancer-associated immunosuppression. Clin Cancer Res. 2017;23(14):3711–3720. doi: 10.1158/1078-0432.CCR-16-3215.
2. Chabanon RM, Muirhead G, Krastev DB, et al. PARP inhibition enhances tumor cell-intrinsic immunity in ERCC1-deficient non-small cell lung cancer. J Clin Invest. 2019;129(3):1211–1228. doi: 10.1172/JCI123319.
3. Pantelidou, C., et al. PARP inhibitor efficacy depends on CD8+ T cell recruitment via intratumoral STING pathway activation in BRCA-deficient models of triple-negative breast cancer. Cancer Discov. 2019; 9: 722–737. doi: 10.1158/2159-8290. CD-18-1218.
4. Sen T, Rodriguez BL, Chen L, et al. Targeting DNA damage response promotes antitumor immunity through STING-mediated T-cell activation in small cell lung cancer. Cancer Discov. 2019;9(5):646–661. doi: 10.1158/2159-8290.CD-18-1020.
5. Vinayak S, Tolaney SM, Schwartzberg L, et al. Open-label clinical trial of niraparib combined with pembrolizumab for treatment of advanced or metastatic triple-negative breast cancer. JAMA Oncol. 2019;5(8):1132–1140. doi: 10.1001/jamaoncol.2019.1029.
6. Konstantinopoulos PA, Waggoner S, Vidal GA, et al. Single-arm phases 1 and 2 trial of niraparib in combination with pembrolizumab in patients with recurrent platinum-resistant ovarian carcinoma. JAMA Oncol. 2019;5(8):1141–1149. doi: 10.1001/jamaoncol.2019.1048.
7. Lee JM, Cimino-Mathews A, Peer CJ, et al. Safety and clinical activity of the programmed death-ligand 1 inhibitor durvalumab in combination with poly (ADP-Ribose) polymerase inhibitor olaparib or vascular endothelial growth factor receptor 1-3 inhibitor cediranib in women’s cancers: a dose-escalation, phase Ⅰ study. J Clin Oncol. 2017;35(19):2193–2202. doi: 10.1200/JCO.2016.72.1340.
上海交通大学医学院附属仁济医院乳腺中心主任
主任医师 ;博士生导师
中国临床肿瘤学会(CSCO)理事
中国医药教育协会乳腺疾病专业委员会副主任委员
中国抗癌协会肿瘤标志专业委员会乳腺癌标志物协作组副组长
中国医师协会外科分会MDT委员会委员
中国医师协会外科分会乳腺专业委员会委员
上海抗癌协会乳腺癌专业委员会副主任委员
上海基因健康专委会常委
曾荣获上海市十佳医生称号(2012年)





 京公网安备 11010502033352号
京公网安备 11010502033352号